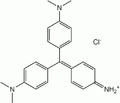
Cristal violeta
El violeta de metilo, comúnmente denominado cristal violeta o violeta de genciana, es el nombre dado a un grupo de compuestos químicos empleados como indicadores de pH y colorantes. El nombre cristal violeta procede de una traducción errónea del nombre en inglés crystal violet, siendo la traducción correcta violeta cristal.
Los violetas de metilo son mezclas de: N-tetra, N-penta y N-hexametil p-rosanilinas. Mediante la mezcla de diferentes versiones, el fabricante puede crear diferentes tonos de violeta en el colorante final. Cuanto más metilado esté el colorante, su color será de un violeta más oscuro:
- Tetrametilo (cuatro metilos) es conocido como Violeta de metilo 2B, y encuentra usos específicos en química y medicina.
- Pentametilo (cinco metilos) es conocido como Violeta de metilo 6B, y es más oscuro como colorante que 2B.
- Hexametilo (seis metilos) es conocido como Violeta de metilo 10B, o específicamente violeta cristal. Es mucho más oscura que la 2B, y aún más oscura que la 6B.
Durante su manipulación hay que proceder con precaución, ya que si el colorante entra en contacto con la piel por períodos prolongados, puede resultar nocivo.
Propiedades y características físicas[editar]
En la forma pura, el cristal violeta se presenta como cristales de color azul verdoso brillante. Su punto de fusión está entre 194-189 °C. Los violeta de metilo son solubles en agua, etanol, dietilenglicol, y dipropilenglicol. En particular, el violeta de metilo 6B es soluble en agua al 2,93% y soluble en etanol al 15,21%.
El violeta de metilo no debe ser confundido con el azul de metilo ni con el azul de metileno, otros dos colorantes. Al ser de diferente composición.
Historia[editar]
El cristal violeta fue inicialmente uno de los componentes del violeta de metilo, un colorante que fue sintetizado por primera vez en 1861 por Charles Lauth. Se trataba de una mezcla de pararosanilinas tetra-, penta- y hexametiladas. A partir de 1866, el violeta de metilo fue producido por la empresa Poirrier et Chappat en Saint-Denis y comercializado bajo el nombre de “Violet de Paris”.[1]
El cristal violeta puro fue sintetizado por primera vez en 1883 por Alfred Kern en forma pura, quien trabajaba en Basilea para la empresa Bindschedler & Busch. Para optimizar la difícil síntesis con fosgeno, Kern colaboró con el químico alemán Heinrich Caro en BASF.[2]
El nombre “violeta de enzian” fue posiblemente introducido por el farmacéutico alemán Georg Grübler, quien fundó en 1880 en Leipzig una empresa especializada en la distribución de reactivos de tinción para histología.[3] La tinción de cristal violeta distribuida por Grübler probablemente contenía una mezcla de colorantes de pararosanilina metilados.[4] Esta tinción resultó ser popular y fue utilizada en 1884 por Hans Christian Gram para teñir bacterias. Gram atribuyó la mezcla de anilina-cristal violeta a Paul Ehrlich. La tinción selectiva de microorganismos en un organismo huésped con diferentes colorantes llevó a Paul Ehrlich a la suposición de que sería posible matar microorganismos sin dañar al organismo huésped. A partir de los trabajos con colorantes, Ehrlich desarrolló los conceptos de “toxicidad selectiva” y “quimioterapia”.[5] El cristal violeta de Grübler era probablemente muy similar, si no idéntico, al violeta de metilo de Lauth, que fue utilizado como colorante por Victor André Cornil en 1875.
El descubrimiento de las propiedades antisépticas del cristal violeta se atribuye al oftalmólogo alemán Jakob Stilling. En 1890, publicó una monografía sobre el efecto bactericida de una solución que llamó “Pyoktanin” y que probablemente era una mezcla de colorantes de anilina similar al cristal violeta.[6] Stilling se asoció con E. Merck & Co. para comercializar el “Pyoktanin caeruleum” como antiséptico.
Carl Benda demostró en 1898, mediante tinción con cristal violeta, la presencia de cientos de gránulos en el citoplasma de células eucariotas y los denominó mitocondrias, del griego mitos, hilo, y khondrion, gránulo. En 1902, Wilhelm von Drigalski y Heinrich Conradi observaron que el cristal violeta inhibe el crecimiento de muchas bacterias, pero tiene solo un efecto leve sobre Bacillus coli (Escherichia coli) y Bacillus typhi (Salmonella typhi), ambos bacterias gramnegativas.[7] Un estudio mucho más detallado sobre el efecto del cristal violeta de Grübler en diversas cepas bacterianas fue publicado en 1912 por John Churchman. Él determinó que la mayoría de las bacterias grampositivas (teñidas) eran sensibles al colorante, mientras que la mayoría de las bacterias gramnegativas (no teñidas) eran insensibles, y observó que el colorante actuaba más como un agente bacteriostático que bactericida.[8]
Obtención[editar]
El violeta de metilo se obtiene por reacción de condensación de la cetona de Michler (4,4'-Bis-dimetilamino-benzofenona) con N,N-dimetilanilina en presencia de clorato de fosforilo.
Usos[editar]
- El principal uso del violeta de metilo (por volumen bruto usado mundialmente) es el de tintura textil de color púrpura y para dar tonos violeta oscuro en pinturas y tinta de impresión.
- El violeta de metilo 2B (llamado sencillamente violeta de metilo) es usado en química como un indicador de pH para probar los intervalos de pH de 0 a 1,0. En el extremo ácido de su intervalo de medición, toma un color amarillo. En el alcalino, se hace violeta azulado. El Violeta de metilo puede ser suministrado como papel de prueba de pH, o puede ser suministrado como cristales puros y disueltos en la muestra a ser probada.
| Violeta de metilo 2B (indicador de pH) | ||
| pH por debajo de 1.6 | pH por encima de 1.6 | |
| amarillo | ⇌ | violeta azulado |
- El violeta cristal 10B es usado en el intervalo de 0 a 1,8, cuando cambia también de amarillo a azul.
- En microbiología, el violeta de metilo 10B es conocido como violeta de genciana y es el ingrediente activo en la Tinción de Gram, usado para clasificar bacterias. El violeta de genciana destruye células, y es usado en desinfectante de intensidad moderada externo. El violeta de genciana es muy venenoso para la mayoría de los animales, cachorros y gatos incluidos; no debe ser usado para desinfección de la piel de estos animales por más de 8 días consecutivos por riesgo a crear una infección más severa.[1]
- El violeta de metilo tiene también la habilidad de conectarse al ADN. Por lo tanto, en ciencias biomédicas, es usado para ensayos de viabilidad celular. La conexión al ADN puede también causar rupturas en el proceso de replicación del ADN, el cual puede llevar a mutaciones y cáncer.
- Normalmente es formulado para uso como indicador de pH en la variedad de violeta de metilo como una solución de 0,01 a 0,05 % en m/v y en la variedad de violeta de cristal como una solución de 0,02 % en m/v en agua.[9]
- En el área de la física, el violeta-cristal se utiliza como un trazador fluorescente y en experimentos de emisión de efectos de óptica no lineal. Por ejemplo en la generación del segundo-armónico-óptico.[10] De hecho su estructura multipolar (octopolar) representa una excelente ruta para observar efectos ópticos no lineales en comparación con los compuestos dipolares.
Estructuras químicas[editar]
-
Violeta de metilo 2B
-
Violeta de metilo 6B
-
Violeta de metilo 10B
- Violeta de metilo 2B:
- Violeta de metilo 6B:
- Violeta de metilo 10B:
Referencias[editar]
- ↑ University of California Libraries, Walter Myers ([1915?]). The British coal-tar industry : its origin, development, and decline (en inglés). Philadelphia : J.B. Lippincott. p. 173. Consultado el 31 de mayo de 2024.
- ↑ Reinhardt, Carsten; Travis, Anthony S. (31 de octubre de 2000). Heinrich Caro and the Creation of Modern Chemical Industry (en inglés). Springer Science & Business Media. pp. 208-209. ISBN 978-0-7923-6602-7. Consultado el 31 de mayo de 2024.
- ↑ Titford, Michael (1993-06). «George Grubler and Karl Hollborn: Two Founders of the Biological Stain Industry». Journal of Histotechnology (en inglés) 16 (2): 155-158. ISSN 0147-8885. doi:10.1179/his.1993.16.2.155. Consultado el 31 de mayo de 2024.
- ↑ Titford, M (2007-01). «Comparison of historic Grübler dyes with modern counterparts using thin layer chromatography». Biotechnic & Histochemistry (en inglés) 82 (4-5): 227-234. ISSN 1052-0295. doi:10.1080/10520290701714005. Consultado el 31 de mayo de 2024.
- ↑ Beobachtung, Experiment und Theorie in Naturwissenschaft und Medizin: 114. Versammlung, 13. - 16. September 1986, München: mit 206 Abbildungen davon 8 in Farbe und 14 Tabellen (en alemán). Stuttgart: Wissenschaftliche Verlagsgesellschaft. 1987. ISBN 3-8047-0912-5.
- ↑ «Sammlung Vester (DFG) / Anilin-Farbstoffe als Antiseptica und ihre Anwendung in der Praxis : / von J. Stilling. Strassburg. 1890». web.archive.org. 13 de febrero de 2022. Consultado el 31 de mayo de 2024.
- ↑ v. Drigalski; Conradi, H. (1 de diciembre de 1902). «Ueber ein Verfahren zum Nachweis der Typhusbacillen». Zeitschrift für Hygiene und Infektionskrankheiten (en alemán) 39 (1): 283-300. ISSN 1432-1831. doi:10.1007/BF02140310. Consultado el 31 de mayo de 2024.
- ↑ «THE SELECTIVE BACTERICIDAL ACTION OF GENTIAN VIOLET». rupress.org (en inglés). doi:10.1084/jem.16.2.221. Consultado el 31 de mayo de 2024.
- ↑ Acid Base Indicators - ifs.massey.ac.nz (en inglés)
- ↑ Torres-Zúñiga, V.; O. G. Morales-Saavedra (2012). «Structural and nonlinear optical properties of Crystal-Violet octupolar dyes dispersed in bulk SiO2-sonogel optical-glasses». Materials Chemistry and Physics. doi:10.1016/j.matchemphys.2012.02.018. Consultado el 16 de marzo de 2012.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre Cristal violeta.
Wikimedia Commons alberga una categoría multimedia sobre Cristal violeta.- Violeta de Metilo 2B y 6B en Stainsfile
- Violeta de Metilo 10B en Stainsfile